Konvergente Varianten (ca. Herbst 2022 bis Februar 2023)
Wirksamkeit therapeutischen Antikörpern
- BA.2.75.2: Evusheld wirkt nicht wegen den Mutationen 486S und 346T, Ronapreve (Casirivimab und Imdevimab) haben jeden antiviralen Effekt verloren, Sotrovimab noch schwach aktiv
- BA.2.75: Evusheld und Bebtelovimab weiterhin (verringert) wirksam
- BQ.1.1: Evusheld und alle bekannten Antikörper wirkungslos
Planas et al., Resistance of Omicron subvariants BA.2.75.2, BA.4.6 and BQ.1.1 to neutralizing antibodies (17.11.22 – 4 Monate nach Auffrischimpfung waren die neutralisierenden Titer in 3fach geimpften Individuen schwach bis nicht nachweisbar gegen BQ.1.1 und BA.2.75.2, eine Durchbruchsinfektion mit BA.1/BA.2 erhöhte diese Titer, blieb aber 18fach niedriger als gegen BA.1, eine BA.5-Durchbruchsinfektion war effektiver gegen BA.5 und BQ.1.1 als gegen BA.2.75.2.)
Arora et al., Omicron sublineage BQ.1.1 resistance to monoclonal antibodies (18.11.22)
Relevante Subvarianten von BA.2
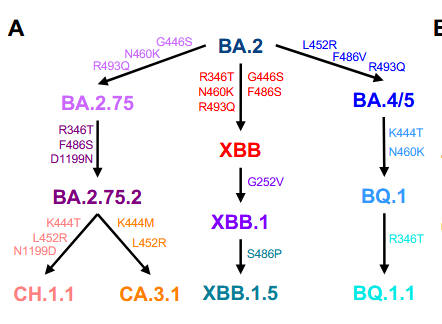
BA.2.75(.2)

Steckbrief:
- 8 Mutationen im Spike-Protein, 16 insgesamt (zum Vergleich: ALPHA hatte 8 im Spike, DELTA 9, BA.5 nur 3)
- Deutlicher Wachstumsvorteil über BA.4/BA.5
- 4 Mutationen in der RBD, kann Infektiösität und Immun Escape erhöhen (DELTA hatte 2)
- 4 Mutationen in NTD (Immun Escape)
- Schlüsselmutationen: G446S (Immun Escape) und R493Q
G446S: Personen mit BA.1-Durchbruchsinfektionen sind wegen besser geschützt gegen BA.2.75. BA.2.75 Vorteil gegenüber BA.2 ist bei Personen ohne BA.1-Infektion am ausgeprägtesten
R493Q: keine markante antigene Mutation, aber ermöglicht F486BV (in BA.4/BA.5) und G446S (BA.2.75), sie kompensiert den Verlust der ACE2-Affinität durch die Escape-Mutationen.
- Sheward et al., Evasion of neutralising antibodies by omicron sublineage BA.2.75 (01.09.22 – Kreuzimmunität mit BA.1/BA.2, Evusheld und Bebtelovimab weiterhin wirksam, nicht mehr Immun Escape als BA.5)
- Yamasoba et al., Neutralization sensitivity of Omicron BA.2.75 to therapeutic monoclonal antibodies (15.07.22, preprint – verringerte Wirksamkeit von Bebtelovimab)
- Sheward et al., Evasion of neutralising antibodies by omicron sublineage BA.2.75 (01.09.22 – Kreuzimmunität mit BA.1/BA.2, Evusheld und Bebtelovimab weiterhin wirksam, nicht mehr Immun Escape als BA.5)
- Indien: Lung infection back among Covid positive elderly (20.08.22, n = 200)
- Cao et al., Characterizations of enhanced infectivity and antibody evasion of Omicron BA.2.75 (10.08.22, preprint – Geimpfte mit BA.5-Infektion schlecht gegen BA.2.75 geschützt, sehr stabile RBD-Konfiguration verglichen mit früheren Varianten, sehr ansteckend)
- Saito et al., Virological characteristics of the SARS-CoV-2 Omicron BA.2.75 (08.08.22, preprint – BA.2.75 kontagiöser als BA.5, in Hamstern unzureichende Immunität durch BA.5 gegen BA.2.75, intrinsische Schwere von BA.2.75 vergleichbar mit BA.5, aber stärker als BA.2 – peer reviewed 09.10.22)
BQ.1.1
Eine kürzliche BA.5-Impfung und/oder Infektion bietet gewissen Schutz gegen BQ.1.1, aber nicht so gut wie gegen BA.5.
BQ.1.1 kommt von BA.5, aber BA.5 stammt von BA.2 ab, XBB ebenfalls und ist aus einer Rekombination von BJ.1 (BA.2.10.1.1) und BM.1.1.1 (BA.2.75.3.1.1.1.) entstanden.


- Kurhade et al., Low neutralization of SARS-CoV-2 Omicron BA.2.75.2, BQ.1.1, and XBB.1 by parental mRNA vaccine or a BA.5-bivalent booster (06.12.22, preprint)
- Zhang et al., Omicron sublineage recombinant XBB evades neutralising antibodies in recipients of BNT162b2 or CoronaVac vaccines (06.12.22)
- Akerman et al., Emergence and antibody evasion of BQ and BA.2.75 SARS-CoV-2 sublineages in the face of maturing antibody breadth at the population level (07.12.22, preprint – An outgrowth advantage through better utilization of TMPRSS2 was observed across BQ lineages and not those derived from BA.2.75. )
- Qu et al., Distinct Neutralizing Antibody Escape of SARS-CoV-2 Omicron Subvariants BQ.1, BQ.1.1, BA.4.6, BF.7 and BA.2.75.2 (20.10.22, preprint)
Deutlich höherer Immun Escape als bei BA.2 oder BA.4/5 – sowohl bei 3x Geimpften als auch allgemein nach Infektion nach BA.1/BA.4-5 Welle. Vermehrt Fusogenizität bei BQ.1.1 im Vergleich zu BA.2/BA.5, wa auf stärkeren Lungenbefall hindeutet [Annäherung DELTA].
Die Mehrheit jener mit BA.1-Durchbruchsinfektion wird nach 7,5 Monaten kaum in der Lage sein, BQ.1.1 und XBB zu neutralisieren (Cao et al., Update 23.10.22).
Cao et al., Imprinted SARS-CoV-2 humoral immunity induces convergent Omicron RBD evolution (19.12.22)
Beginn der Rekombinanten
XBB.1.5
XBB ist eine Rekombinante von BA.2.10.1.1 (BJ.1) und BA.2.75.3.1.1 (BM.1.1.1) und sehr wahrscheinlich durch eine chronische Infektion entstanden. Chronische Infektionen sind mutmaßlich für viele neue Varianten verantwortlich. Daher wäre es besonders wichtig, Medikamente zu haben, um chronische Infektionen zu verhindern.

- Eric Topol: A new variant alert (23.12.22 – steigende Hospitalisierungen in New York vor allem bei älteren Menschen, Schlüsselmutation F486P, größter Wachstumsvorteil aller bekannten Varianten gegenüber BA.5, nicht evasiver als XBB, aber infektiöser, bessere Bindung an ACE2-Rezeptor. USA nach Singapur das zweite Land, wo XBB dominant wird, Rt mit 1.6-1.8 höher als alle Varianten seit Jänner 2022)
- 120%-Wachstumsvorteil über BQ in New York
- Steigende Hospitalisierung auch in Connecticut
- BA.4/BA.5 hatten F486V, XBB F486S – Mutationen auf 486 verringern ACE2-Affinität, höherer Immun Escape auf Kosten Rezeptorbindung (“evolutionary tradeoff”), mit Ausnahme F486P
- Unterschied zwischen XBB.1.5 und XBB ist, dass die kostspieligere F486S gegen F486P ausgetauscht wurde, daher hat XBB.1.5 nicht mehr Immun Escape als XBB.1 (was bereits F486 hat), aber bessere ACE2-Affinität (höhere Übertragbarkeit)
- Arora et al., Neutralisation sensitivity of the SARS-CoV-2 XBB.1 lineage (05.01.23 – Laborstudie, XBB.1 entkommt auch Immunschutz durch Mehrfachimpfung)
- Qu et al., Extraordinary Evasion of Neutralizing Antibody Response by Omicron XBB.1.5, CH.1.1 and CA.3.1 Variants (17.01.23 – höhere Fusogenität bei XBB.1.5, bivalente Impfstoffe weiterhin wirksam)
- Lasrado et al., Waning Immunity Against XBB.1.5 Following Bivalent mRNA Boosters (23.01.23 – F486P sorgt für mehr Transmissibilität wie vermutet, aber nicht mehr Immun Escape – T-Zellen-Antwort bleibt erhalten, nicht aber NAb )
- Luoma et al., Epidemiologic Characteristics of SARS-CoV-2 Recombinant Variant XBB.1.5 — New York City, November 1, 2022–January 4, 2023 (24.02.23 – frühe Daten zeigen kein Unterschied in der Krankheitsschwere, verglichen mit früheren Varianten; Limitation: LongCOVID-Ausprägung wissen wir noch nicht)
- Chen et al., Protective effect of plasma neutralization from prior SARS-CoV-2 Omicron infection against BA.5 subvariant symptomatic reinfection (19.02.23 – Durchsbruchsinfektionen mit BF.7/BA.5 können für ca. 4 Monate gegen symptomatische CH.1.1/XBB.1.5 Reinfektion schützen)
Update, 13.01.23 – in NY und evtl. UK Peak erreicht, keine schwereren Akutverläufe durch XBB.1.5, unklar, ob LongCOVID-Risiko verändert ist.
In Japan hat BF.5* die Mutation ORF3a:D155Y ausgebildet, die die asymptomatische Phase verlängert, d.h., man überträgt längere Zeit, bevor man erste Symptome zeigt (Gupta et al., 2022).
DN.1.1*, DS.1*, several BN.1*, recombinants including XBB.1*, XBF*, XAY.1.1* are in the zone of concern (red box) – Predicted to have high immune escape and tight ACE2 binding affinity! DS.1*, XBB.1.8*, XBB.1.10*, XBB.1.12* and DN.1.1.1* stand out! (Raj Rajnarayanan, 28.02.23)
XBB.1.16
Schlüsselmutation: ORF1a:L3829F an der Stelle NS96 vonORF1b
“Die vorherigen Varianten zeigten eine konvergente Entwicklung am Spike-Protein. Die neue Virusstrategie ist nun, der T-Zellen-Immunität zu entkommen, indem mehr Mutationen in den Nicht-Spike-Regionen wie N-Protein und ORF-Proteine induziert werden. Diese Änderungen zeigen sich derzeit in den neuen Sublinien wie XBB.1.16, XBB.1.9.1., CH.1.1.12 und anderen Sublinien von XBB.1.5.
Diese Varianten sind effizienter darin, die Kommunikation zwischen virusinifizerten Zellen und T-Zellen zu blockieren. Daher wird es den T-Zellen erschwert, infizierte Zellen zu erkennen und anzuzielen, so kann das Virus replizieren, sich ungehindert verbreiten und länger im Körper verweilen. Falls das Virus damit erfolgreich ist, wird es den infizierten Personen schwerer fallen, das Virus loszuwerden, was zu chronischen Entzündungen und mehr LongCOVID/Autoimmunerkrankungen führen kann.”
(Quelle: @vipintukur, 29.03.23, Kinderarzt, Impfexperte)
Relativ-effektive Reproduktionszahl (Re) von XBB.1.16 ist rund 1,3fach höher als von XBB.1 und rund 1,2fach höher als von XBB.1.5. Infektiösität von XBB.1.16 vergleichbar mit XBB.1, das heißt, Immun Escape ist höher!
Labordaten zeigen, dass XBB.1.16 stark resistent gegenüber BA.2 Durchbruchsinfektions-Serum (18fach vs. B.1.1) und BA.5-Durchbruchsinfektion (37fach vs. B.1.1) ist.
- In Summe ist XBB.1.16 fitter als andere XBB-Varianten, vor allem wegen unterschiedlicher Antigenizität von XBB.1.5 sowie Mutationen in den Non-Spike-Regionen. Gute Nachricht: Der therapeutische Antikörper Sotrovimab wirkt noch abgeschwächt gegen XBB-Subvarianten einschließlich XBB.1.16. (Yamasoba et al. 06.04.23, preprint).
- Arcturus,’ a highly transmissible COVID variant eyed by the WHO, appears to have a new symptom. Here’s what you need to know (11.04.23 – Bindehautentzündung scheint v.a. bei Kindern häufiger aufzutreten)
- Vashishta and Kumar, Preliminary clinical characteristics of Pediatric Covid-19 cases during the ongoing Omicron XBB.1.16 driven surge in a north Indian city (20.04.23, preprint – bei 42,8% Konjunktivitis bei Kindern bestätigt, meist milde fieberhafte Infekte, Atemwegsssymptome dominieren )
- Karyakarte et al., Chasing SARS-CoV-2 XBB.1.16 Recombinant Lineage in India and the Clinical Profile of XBB.1.16 cases in Maharashtra, India (26.04.23, preprint – keine Änderung in der Schwere der Verläufe, aber: auch keine leichteren Verläufe!)
- Yamasoba et al., Virological characteristics of the SARS-CoV-2 omicron XBB.1.16 variant (03.05.23)
- Tamura et al., Virological characteristics of the SARS-CoV-2 XBB variant derived from recombination of two Omicron subvariants (16.05.23 )
Stand 23-25.4.23 – steigende Fallzahlen
- Frankreich 34% Anstieg bei Neuinfektionen in einer Woche von 45521 auf 60799
- Anstiege auch in Indien, Südkorea, Japan, Deutschland, Italien (um 28,5%, Todeszahlen um 48% in einer Woche) und Mexiko
- Dänemark, Irland, Indonesien, Kroatien, Iran (deutlich) Anstieg bei Todesfällen
- Finnland Anstieg bei Intensivpatienten
- Singapur: Anstieg bei Covidfällen, Hospitalisierung und Intensivpatienten
Stand, 14.05.23: XBB.1.16 hat ca. 7% Anteil in Österreich und wächst langsam in relativen und absoluten Zahlen. Der Gesamt-Abwassertrend zeigt aber noch nach unten.
19.05.23: Australien neben schwerer Influenzawelle in Covid-Welle (seit Mitte März 74% Zunahme bei Fällen und 95% bei Hospitalisierungen), erste Schulen ins Distance Learning geschickt
XBB.2.3?
1225 Covid-Tote in Südostasien in den letzten 28 Tagen (Zunahme von 153%)
Stand, 23.05.23: ca. 40 Mio Infektionen pro Woche in China bis Ende Mai, ca. 40% Reinfektionen, bald XBB-Impfstoffe in China
Stand, 19. Juli 2023:

EG.5.1
am 19.07. von der WHO als Variant of Monitoring, seit 09.08. als Variant of Interest geführt.

EG.5 (XBB.1.9.2.5) ging aus XBB.1.5 plus zusätzliche Spike-Mutation F456L hervor. EG.5.1 ist durch eine weitere Spike-Mutation S:Q52H entstanden und breitet sich seit Mai/Juni aus: Die Aminosäure an der Position 52 ändert sich von Glutamin zu Histidin.

- Die Kombination aus XBB+L455F und F456L nimmt ebenso rasch zu und macht derzeit über 2% der Genomsequenzen weltweit aus.
- F456L bedeutet Immun Escape, sogar nach XBB-Infektion
- L455F und F456L gemeinsam verstärken Immun Escape und könnten außerdem ACE2-Binding verstärken
- Der Aufstieg der 455 und 456-Mutationen wurde bereits vor einem halben Jahr vorhergesagt. Interessanterweise wird die Mutation F456L auf dem Rückgrat von XBB.15 viel besser toleriert als bei BA.2, was erklären könnte, weshalb jetzt diese Mutation jetzt erst ansteigt.
- Diesen Winter können wir weitere XBB-Abkömmlinge erwarten, die Kombinationen wie L455F, F456L, K478R tragen oder sogar zusätzliche Immunfluchtmutationen (Quelle: Yunlong Richard Cao, 05.08.23)
Bei Symptomen und Inkubationszeit aus jetziger Sicht noch keine Veränderung.
Kaku et al., Antiviral efficacy of the SARS-CoV-2 XBB breakthrough infection sera against Omicron subvariants including EG.5 (08.08.23, preprint – EG.5.1 weist höheres R_e auf, aber ist weder infektiöser noch immunflüchtiger als vorherige Varianten; XBB-Durchbruchsinfektionen können keine effektive Antikörperantwort gegen XBB-Subvarianten aufbauen, alias kurzlebige Immunität)
Cornelius Roemer hielt am 11.08.23 auf Twitter fest, dass EG.5. sich viel langsamer als ALPHA, DELTA, BA.1 und BA.5 ausbreitet, weil es sich durch antigenic drift entwickelt und nicht durch große evolutionäre Sprünge. EG’s Wachstumsvorteil reicht nicht aus, um aus eigenen Antrieb Wellen zu produzieren, hinzukommen nachlassender Immunschutz, saisonale Faktoren und Verhaltensänderungen.
EG.5 ist nicht die erste XBB-Variante, die die 456L-Mutation erlangt hat. Die erste war XBB.1.5.10 im Februar. Es scheint so, als hätte 456L keinen Wachstumsvorteil geboten. Der wurde größer, als die Bevölkerungsimmunität gegen XBB zugenommen hat (mehr dazu auf Github).
BA.2.86

seit 17.08. von der WHO als Variant of Monitoring geführt (das ging schnell)
13. August: Israel sequenziert Variante mit 18 RBD-Mutationen (3 Reversionen und eine Deletion), 69-70,144 und 211 dels, 4 AA insertion und reichlich Mutationen in der NTD, 681 drehen zu R
Die Variante ist weiter weg von BA.2 als als vom Wildtyp, der Patient hatte Kontakt mit zwei Personen, die vorher infiziert waren, alle drei waren nicht immunsupprimiert oder chronisch infiziert. Variante zirkuliert wahrscheinlich schon international.
14. August: Zwei weitere Sequenzen in Dänemark aufgetaucht, nahezu identisch, 34 Spike-Mutationen, darunter F486P, H681R, G446S (Immun Escape) und R493Q, welche den Verlust der ACE2-Affinität durch Escape-Mutationen ausgleicht.
Im Vergleich zu EG.5.1. 24 neue Spike-Mutationen, OMICRON hatte gegenüber DELTA 32 neue Mutationen.
Beitrag von Adam Kucharski mit Erklärungen zur weiteren Virus-Evolution (16.08.23)
17. August: In Michigan wurde eine weitere Sequenz gefunden, die den bisherigen ähnlich sieht. Augenscheinliche Differenzen waren Sequenzierartefakten geschuldet. Die Wahrscheinlichkeit, dass sich die Variante rapide ausbreitet, ist gestiegen.
You must be logged in to post a comment.